Axit sunfuric là một hợp chất hóa học vô cùng phổ biến và được ứng dụng rộng rãi trong đời sống xã hội. H2SO4 là gì? Tính chất vật lý và hóa học của Axit này là gì? Hãy cùng tìm hiểu về H2SO4 ngay sau đây.
H2SO4 là gì?
H2SO4 (Axit Sunfuric) được mệnh danh là vua trong hóa học. Đóng vai trò vô cùng quan trọng đối với sự phát triển của các ngành công nghiệp hiện nay.
H2SO4 là axit vô cơ thông dụng nhất hiện nay. Nó được tạo thành từ các nguyên tố lưu huỳnh (S), oxy (O) và hydro (H). Công thức hóa học của axit này là H2SO4. Tên tiếng anh của H2SO4 là Sulfuric Acid. Axit này còn được gọi là Oil Sulfate và Hydrogen Sulfate.
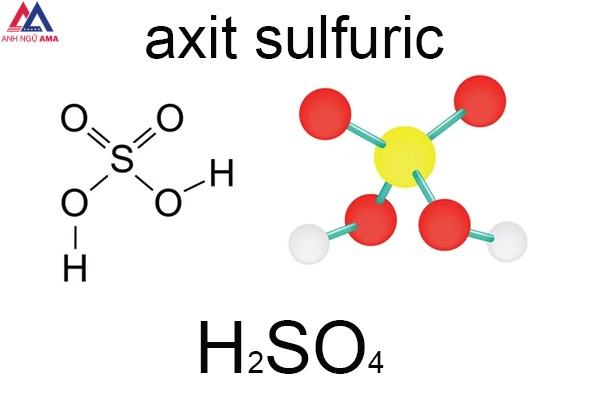 H2SO4 là gì?
H2SO4 là gì?
Ôn tập bảng tuần hoàn các nguyên tố hóa học
Tính chất vật lý của H2SO4
Tính chất vật lý của H2SO4 đặc hay loãng đều giống nhau, nó là chất lỏng không màu, không mùi, không vị, hơi sánh. H2SO4 khó bay hơi, nặng hơn nước và tan vô hạn trong nước.
Axit sunfuric rất ưa nước và khi được hấp thụ, nó tỏa nhiều nhiệt. Khi làm thí nghiệm chỉ được cho từ từ H2SO4 đặc vào nước. Tuyệt đối không làm ngược lại vì Axit sẽ bắn lên gây bỏng.
H2SO4 có thể cacbon hóa các hợp chất hữu cơ.
Tính chất hóa học của H2SO4
H2SO4 có một axit rất mạnh, tính ăn mòn của axit này cũng rất đáng kể. Axit sunfuric có thể gây nguy hiểm cho bất cứ thứ gì chạm vào nó ở một số nồng độ nhất định.
Axit sunfuric có độ bay hơi tương đối thấp nên đóng vai trò quan trọng trong việc điều chế axit dễ bay hơi. Do có đặc tính ưa nước nên H2SO4 còn được dùng để làm khô nhiều chất khí không phản ứng với axit.
Tính axit của H2SO4 có thể làm quỳ tím hóa đỏ.
Axit sunfuric tồn tại ở hai dạng: axit đặc và axit loãng.
 Tính chất hóa học của H2SO4
Tính chất hóa học của H2SO4
Tính chất hóa học của H2SO4 đặc
Trong H2SO4, lưu huỳnh nguyên tố có trạng thái oxi hóa cao nhất +6 của nguyên tố này. Kết quả là H2SO4 đặc có tính axit mạnh, có tính oxi hóa và ưa nước.
Do có tính axit mạnh nên H2SO4 có thể phản ứng với hầu hết các kim loại (trừ Au và Pt). Axit sunfuric đặc, nóng phản ứng với Kim loại tạo thành muối kim loại hóa trị cao, nước và SO2 (H2S, S).
2Al +H2SO4 đặc nóng → Al2(SO4)3 + 3SO2 + 6H2O
Cu + H2SO4 đặc nóng → CuSO4 + SO2 + 2H2O
2Fe +H2SO4 đặc nóng → Fe2(SO4)3 + 3SO2 + 6H2O
3Cr + 4H2SO4 đặc nóng → 3CrSO4 + 4H2O + S
H2SO4 đặc nguội sẽ bị nhôm (Al), sắt (Fe) và crom (Cr) thụ động hóa nên không phản ứng được.
Axit sunfuric đậm đặc phản ứng với phi kim tạo thành oxit phi kim, nước và SO2. khí ga
S +2H2SO4 đặc nóng → 3SO2 + 2H2O
Axit sunfuric đặc nóng phản ứng với các chất khử khác tạo thành muối, nước và SO2. khí ga
H2SO4 đặc nóng + 8HI → H2S + 4I2 + 4H2O
H2SO4 đậm đặc ưa nước
Thí nghiệm: Cho H2SO4 đặc vào lọ đường. Quan sát hiện tượng ta thấy vạch chuyển sang màu đen và sôi.
Phương trình mô tả phản ứng này như sau:
C12H22O11 + H2SO4 → 12C + H2SO4 .11H2O
Tính chất hóa học của H2SO4 loãng
Axit sunfuric loãng là một axit mạnh, có đầy đủ các tính chất của một axit thông thường như:
– H2SO4 làm quỳ tím hóa đỏ.
– Phản ứng với Kim loại, Bazơ, Oxit của Bazơ và muối để tạo ra các chất cần thiết.
– Axit sunfuric tác dụng với các kim loại đứng trước H trừ PB tạo thành muối sunfat:
Fe + H2SO4 → FeSO4 + H2 bay hơi.
– Axit sunfuric tác dụng với oxit bazơ tạo muối mới và nước:
FeO + H2SO4 → FeSO4 + H2O
– Axit sunfuric tác dụng với Bazo tạo muối mới + nước:
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
– Axit sunfuric tác dụng với muối tạo thành axit mới và muối mới:
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2↑
HCO3 là một Axit yếu nên khi sinh ra nhanh chóng trở thành H2O và CO2.
Các dạng axit sunfuric (H2SO4)
Tùy theo mục đích sử dụng mà H2SO4 tồn tại ở nhiều dạng khác nhau:
- H2SO4 loãng dùng trong phòng thí nghiệm chỉ là 10%.
- Axit sunfuric dùng cho ắc quy có nồng độ khoảng 33,5%.
- Hàm lượng 62,18% thường dùng để sản xuất phân bón.
- Trong tháp sản xuất hoặc găng axit, hàm lượng H2SO4 đã dùng là 77,67%.
- Axit sunfuric đậm đặc có nồng độ 98%.
Tham khảo bảng đơn vị đo khối lượng
Cách điều chế H2SO4
Đốt quặng pyrit sắt là một trong những cách phổ biến để điều chế H2SO4; Oxy hóa SO2 qua oxy ở nhiệt độ từ 400 đến 500 độ C; Hoặc pha loãng oleum với lượng nước vừa đủ để tạo thành H2SO4.
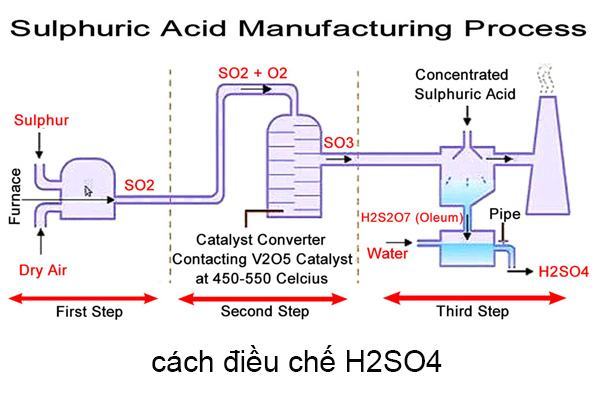 cách điều chế h2so4
cách điều chế h2so4
Đốt quặng pyrit sắt
FeS2 + O2 → SO2 + Fe2O3
Oxi hóa SO2 bằng oxi ở nhiệt độ 400 – 5000C, cần V2O. chất xúc tác
SO2 + O2 → SO3
Axit sunfuric đặc H2SO4 hấp thụ SO3 tạo oleum
nSO3 + H2SO4 → H2SO4.nSO3
Pha loãng oleum với nước
H2SO4 .nSO3 + (n+1)H2O→ (n+1)H2SO4
Xem thêm tài liệu Hóa học tại Trung Tâm Đào Tạo Việt Á
Ứng dụng của H2SO4
Axit sunfuric được sử dụng rộng rãi trong nhiều ngành công nghiệp làm nguyên liệu chính hoặc chất xúc tác của các phản ứng hóa học. H2SO4 được sử dụng nhiều trong sản xuất phân bón, chất tẩy rửa tổng hợp, sợi hóa học, chất dẻo và sơn.
Điều chế axit nitric, axit clohiđric trong phòng thí nghiệm
Axit sunfuric được dùng để điều chế axit yếu hơn như HCl, HNO3. Đáp ứng nhu cầu hóa chất trong phòng thí nghiệm.
H2SO4 trong công nghiệp
Ước tính có khoảng 160 triệu tấn axit sunfuric được sử dụng hàng năm. H2SO4 được sử dụng rộng rãi và nổi bật trong sản xuất luyện kim, thuốc nhuộm, chất dẻo, chất tẩy rửa, giấy và sợi…
H2SO4 là một axit mạnh nên được sử dụng phổ biến trong sản xuất đồng, kẽm… Tẩy rửa bề mặt sắt thép hay dung dịch tẩy rỉ sét.
Sản xuất nhôm sunfat từ H2SO4 là phương pháp tối ưu. Axit sunfuric còn được dùng để sản xuất muối sunfat, làm sạch kim loại trước khi mạ, chế tạo thuốc nổ, v.v.
Hỗn hợp H2SO4 với nước được sử dụng rộng rãi trong pin làm chất điện phân.
H2SO4 trong xử lý nước thải
Axit sunfuric được sử dụng để sản xuất nhôm hydroxit. Sau đó, nhôm hydroxit được sử dụng để lọc tạp chất, cũng như cải thiện mùi vị của nước, giúp trung hòa độ pH trong nước và sử dụng để loại bỏ các ion kim loại như Mg2+, Ca2+ có trong nước thải. Ngoài ra H2SO4 còn có nhiều ứng dụng rộng rãi, bao trùm nhiều mặt của cuộc sống.
Qua bài viết chúng ta đã biết được H2SO4 là gì, tính chất, cách sản xuất và công dụng của nó. Trung Tâm Đào Tạo Việt Á mong muốn gửi đến độc giả những kiến thức hữu ích nhất về loại hợp chất hóa học này.
Bạn thấy bài viết H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4 có đáp ướng đươc vấn đề bạn tìm hiểu không?, nếu không hãy comment góp ý thêm về H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4 bên dưới để vietabinhdinh.edu.vn có thể thay đổi & cải thiện nội dung tốt hơn cho các bạn nhé! Cám ơn bạn đã ghé thăm Website: vietabinhdinh.edu.vn
Nhớ để nguồn bài viết này: H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4 của website vietabinhdinh.edu.vn
Chuyên mục: Giáo dục
Tóp 10 H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4
#H2SO4 #là #gì #Tính #chất #các #dạng #và #ứng #dụng #của #H2SO4
Video H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4
Hình Ảnh H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4
#H2SO4 #là #gì #Tính #chất #các #dạng #và #ứng #dụng #của #H2SO4
Tin tức H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4
#H2SO4 #là #gì #Tính #chất #các #dạng #và #ứng #dụng #của #H2SO4
Review H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4
#H2SO4 #là #gì #Tính #chất #các #dạng #và #ứng #dụng #của #H2SO4
Tham khảo H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4
#H2SO4 #là #gì #Tính #chất #các #dạng #và #ứng #dụng #của #H2SO4
Mới nhất H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4
#H2SO4 #là #gì #Tính #chất #các #dạng #và #ứng #dụng #của #H2SO4
Hướng dẫn H2SO4 là gì? Tính chất, các dạng và ứng dụng của H2SO4
#H2SO4 #là #gì #Tính #chất #các #dạng #và #ứng #dụng #của #H2SO4