Kiến thức hóa học là kiến thức cần thiết cho mọi người. Đặc biệt là phần phương trình phản ứng đây là một kiến thức cần nắm vững hơn. Vì vậy hôm nay chúng tôi sẽ mang đến bài viết về phương trình ion rút gọn của phản ứng để mọi người củng cố thêm những kiến thức cần thiết. Hãy cùng củng cố kiến thức qua bài viết ngay dưới đây.

-
Khái niệm về phương trình ion thu gọn
Phương trình ion rút gọn của phản ứng sẽ cho biết bản chất của phản ứng xảy ra trong dung dịch chất điện ly.
-
Lưu ý khi viết phương trình ion thu gọn
Để viết phương trình ion thu gọn, bạn phải nắm vững về độ tan, độ bay hơi, chất điện li yếu và thứ tự xuất hiện các chất trong dung dịch.
Khi viết phương trình ion chất rắn, khí, nước viết dưới dạng phân tử. Các chất tan trong dung dịch được viết dưới dạng ion
Phương trình ion thu gọn là phương trình hóa học trong đó các ion kết hợp với nhau.
-
Các bước viết phương trình ion thu gọn như sau:
– Bước 1: Viết phương trình phản ứng trong đó các chất phản ứng và sản phẩm đều ở dạng phân tử (nhớ cân bằng phương trình).
– Bước 2: Viết chất điện ly mạnh dưới dạng ion. Chất không tan, chất khí và chất điện li yếu viết dưới dạng phân tử => đủ phương trình ion.
– Bước 3: Khử các ion giống nhau ở 2 vế => phương trình ion thu gọn.
* Nếu một bài toán có nhiều tính chất hỗn hợp nhưng có cùng một phương trình ion rút gọn thì có thể dùng phương trình ion rút gọn để tính yêu cầu bài toán và giải bài toán đó một cách trọn vẹn, nhanh chóng.
* Hỗn hợp axit, bazơ đặc với nhau thì phải dùng phương trình ion rút gọn H+ + OH–→ H2O để giải.
-
Các dạng bài tập và cách giải phương trình ion thu gọn
Ta có thể sử dụng phương trình ion rút gọn để giải các bài toán có phản ứng axit – bazơ, phản ứng hòa tan hiđroxit lưỡng tính, oxit axit tác dụng với bazơ, phản ứng kết tủa, phản ứng oxi hóa. – khử trộn.
-
phương pháp giải quyết
– Tính khối lượng chất đã cho trong bài
– Cần xác định số mol của các ion thiết yếu
Viết phương trình ion rút gọn của các phản ứng xảy ra
– Tính theo phương trình ion thu gọn
– Từ đó ta sẽ tính được các đại lượng cần thiết như: lượng kết tủa, khối lượng muối, pH dung dịch, loại sản phẩm khử,…
II. Các dạng phản ứng khi sử dụng phương trình ion rút gọn
-
Phản ứng giữa axit và bazơ: (Phản ứng trung hòa)
Với phương trình phân tử là:
HCl + NaOH → NaCl + H2O
H2SO4 + 2KOH → K2SO4 + 2H2O
– Phương trình ion:
H+ + Cl – + Na+ → Cl – + Na+ + H2O
2H+ + SO42 – + 2K+ + 2OH – → SO42 – + 2K+ + H2O
Phương trình ion thu gọn là:
H + + OH – → H2O
Theo phương trình phản ứng dạng ion thu gọn: nH + = nOH –
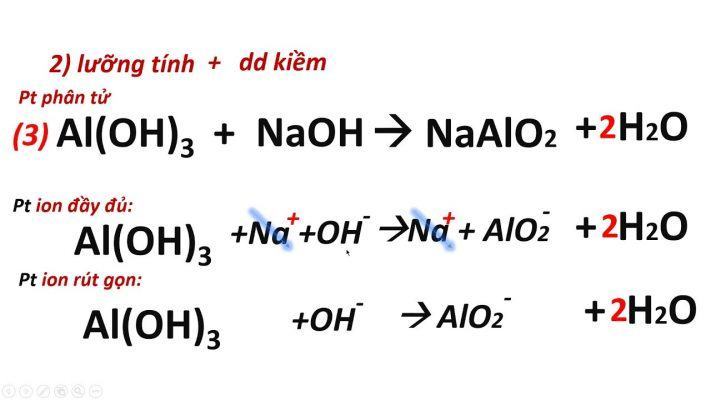
-
Phản ứng oxit axit và kiềm
– Phương trình phân tử:
CO2 + 2KOH → K2CO3 + H2O
Hoặc CO2 + KOH → KHCO3
– Phương trình ion: CO2 + 2K+ + 2OH – → 2K+ + CO32 – + H2O
Hoặc CO2 + K+ + OH– → K+ + HCO3–
Phương trình ion thu gọn:
CO2 + 2OH – → CO32 – + H2O
Hoặc CO2 + OH – → HCO3 –
-
Phản ứng giữa axit và muối
- Nếu ta cho từ từ axit vào muối cacbonat
– Phương trình phân tử:
HCl + Na2CO3 → NaHCO3 + NaCl
HCl + NaHCO3 → NaCl + CO2 + H2O
– Phương trình ion:
H+ + Cl– + 2N a+ + CO32–→ Na+ + HCO3– + Na+ + Cl–
H+ + Cl – + HCO3 – + Na+ → Na+ + Cl – + CO2 + H2O
Phương trình ion thu gọn là:
H+ + CO32 – → HCO3 –
HCO3 – + H + → CO2 + H2O
- Nếu cho từ từ muối cacbonat vào axit
– Phương trình phân tử: 2HCl + Na2CO3 → 2NaCl + CO2 + H2O
– Phương trình ion: 2H+ + 2C l– + 2N a+ + CO32–→ 2N a+ + 2C l– + CO2 + H2O
– Phương trình ion rút gọn: 2H+ + CO32 – → H2O + CO2

- Nếu chúng ta thêm một muối khác vào axit:
– Phương trình phân tử: HCl + AgNO3 → AgCl + HNO3
– Phương trình ion: H+ + Cl – + Ag+ + NO3 – → AgCl + H+ + NO3 –
– Phương trình ion rút gọn: Cl – + Ag+ → AgCl
-
Tác dụng của hai dung dịch muối với nhau
– Phương trình phân tử:
Na2CO3 + MgCl2 → MgCO3 + 2NaCl
– Phương trình ion:
2Na+ + CO32–+ Mg2+ + Cl–→ MgCO3 + 2Na+ + 2Cl–
Phương trình ion thu gọn:
CO32 – + Mg2+ → MgCO3
– Phương trình phân tử:
Fe2(SO4)3 + 3Pb(NO3)2 → 2Fe(NO3)3 + 3PbSO4
– Phương trình ion
2Fe3+ + 3SO42 – + 3Pb2+ + 6NO3 – → 2Fe3+ + 6NO3 – + 3PbSO4
Phương trình ion thu gọn:
Pb2+ + SO42 – → PbSO4
-
kim loại phản ứng axit
– Phương trình phân tử:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
– Phương trình ion:
2Cu + 8H+ + 8NO3 – → 3Cu2+ + 6NO3 – + 2NO + 4H2O
Phương trình ion thu gọn:
3Cu + 8H+ + 2NO3 – → 3Cu2+ + 2NO + 4H2O
-
oxit bazơ axit
– Phương trình phân tử:
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
– Phương trình ion:
Fe2O3 + 6H+ + 3SO42 – → 2Fe3+ + 3SO42 – + 3H2O
Phương trình ion thu gọn:
Fe2O3 + 6H+ → 2Fe3+ + 3H2O
phần kết
Những kiến thức cần thiết về phương trình ion thu gọn của phản ứng trên. Hi vọng những thông tin này sẽ giúp mọi người củng cố lại kiến thức cần thiết để vận dụng làm bài tập hay ứng dụng trong cuộc sống. Hãy cùng chia sẻ kiến thức này với mọi người xung quanh.
Bạn thấy bài viết phương trình ion rút gọn của phản ứng cho biết có đáp ướng đươc vấn đề bạn tìm hiểu không?, nếu không hãy comment góp ý thêm về phương trình ion rút gọn của phản ứng cho biết bên dưới để vietabinhdinh.edu.vn có thể thay đổi & cải thiện nội dung tốt hơn cho các bạn nhé! Cám ơn bạn đã ghé thăm Website: vietabinhdinh.edu.vn
Nhớ để nguồn bài viết này: phương trình ion rút gọn của phản ứng cho biết của website vietabinhdinh.edu.vn
Chuyên mục: Giáo dục
Tóp 10 phương trình ion rút gọn của phản ứng cho biết
#phương #trình #ion #rút #gọn #của #phản #ứng #cho #biết
Video phương trình ion rút gọn của phản ứng cho biết
Hình Ảnh phương trình ion rút gọn của phản ứng cho biết
#phương #trình #ion #rút #gọn #của #phản #ứng #cho #biết
Tin tức phương trình ion rút gọn của phản ứng cho biết
#phương #trình #ion #rút #gọn #của #phản #ứng #cho #biết
Review phương trình ion rút gọn của phản ứng cho biết
#phương #trình #ion #rút #gọn #của #phản #ứng #cho #biết
Tham khảo phương trình ion rút gọn của phản ứng cho biết
#phương #trình #ion #rút #gọn #của #phản #ứng #cho #biết
Mới nhất phương trình ion rút gọn của phản ứng cho biết
#phương #trình #ion #rút #gọn #của #phản #ứng #cho #biết
Hướng dẫn phương trình ion rút gọn của phản ứng cho biết
#phương #trình #ion #rút #gọn #của #phản #ứng #cho #biết